清空記錄
歷史記錄
取消
清空記錄
歷史記錄



【技術原理】
宏基因組(Metagenomics),又稱元基因組,是以特定環境中的整個微生物群落作為研究對象,采用新一代高通量測序技術(NGS),對整個環境DNA進行大規模測序,隨后通過生物信息學方法進行基因搜索和功能注釋,獲得環境微生物基因信息總和,在研究環境微生物的群落結構、物種分類、系統進化關系的基礎上,可進一步探究微生物的基因功能活性、相互協作關系及微生物與環境之間的相互關系。
【技術優勢】
宏基因組測序擺脫了傳統研究中微生物分離培養的技術限制,直接提取環境樣本 DNA 進行測序,具有通量高、速度快、信息全等特點,在鑒定低豐度的微生物群落、挖掘更多基因資源方面具有很大優勢。
與微生物擴增子測序相比,宏基因組測序有其獨特的優勢。微生物擴增子測序靶向測序基因組上的一小段可反映物種進化地位的基因片段,可用于鑒定物種組成。宏基因組則是測序樣本的所有DNA,可以獲得樣本中物種組成和功能組成。所以,擴增子測序可以回答樣本中有哪些微生物,而宏基因組測序則不僅能回答樣本中有哪些微生物,還能回答它們有哪些功能潛力。
【研究方向】
基于測序技術和生物信息學的快速發展,宏基因組技術優勢在微生物研究領域中愈發明顯,應用范圍愈發普遍。在數據庫中積累大量新數據和發展更復雜的生物信息學方法,促使基于測序的宏基因組作為感興趣的功能活性篩選應用中可選擇的方法之一。基于測序的宏基因組,也提供了一種基于群落功能、群體功能差異化比較以及功能菌株搜尋探索的一種方法。
● 醫學領域:人體微生物與慢性疾病、tumor cancer、免疫系統、神經系統、母嬰/生殖、藥物療效關系的研究等
● 畜牧領域:腸道、瘤胃微生物與動物健康/營養消化關系的研究等
● 農業領域:土壤/根際微生物與植物互作、農業耕作/施肥處理關系的研究等
● 環境領域:微生物與環境污染物處理、石油降解及海洋環境的研究等
● 生物能源:特殊功能的菌株、基因挖掘、工程菌的開發研究
● 特殊極端環境:極端環境條件下的微生物類群研究
【案例介紹】

標題:一組通用的腸道微生物來源的標志物可預測肝硬化
期刊:Cell Metabolism
影響因子:29
研究對象:NAFLD肝硬化
1.研究背景
非酒精性脂肪性肝病(NAFLD)是世界范圍內慢性肝病的主要病因,NAFLD肝硬化是該病的the latest of Late形式,也是肝細胞cancerHCC)的主要危險因素。目前迫切需要準確的、非侵入性的檢測來確定晚期NAFLD風險大的患者。
腸道菌群紊亂與非酒精性脂肪肝進一步發展為晚期纖維化和肝硬化的過程密切相關,在一些研究中發現腸道菌群的特征可準確檢測肝硬化患者。然而,考慮到宿主和環境因素對腸道菌群的影響,基于微生物的診斷特征的普遍適用性尚不清楚。
2.研究方法
這項研究納入了163個來自正常對照和NAFLD肝硬化患者及其家庭成員的糞便樣本進行宏基因組測序和非靶向代謝組學檢測,探究NAFLD肝硬化相關的微生物和代謝特征。隨后,通過隨機森林機器學習和差異豐度分析,分別構建基于宏基因組和代謝組數據的NAFLD肝硬化診斷模型,篩選出能指示NAFLD肝硬化的菌群和代謝標志物。Final,研究者分別在51名非NAFLD、21名無進展纖維化的NAFLD患者、3名NAFLD相關纖維化患者和7名NAFLD-肝硬化患者的一級隊列,同時結合已發表的不同地域和宿主遺傳背景的相關研究中的隊列數據中再次驗證了該模型的診斷準確性。
3.研究結果
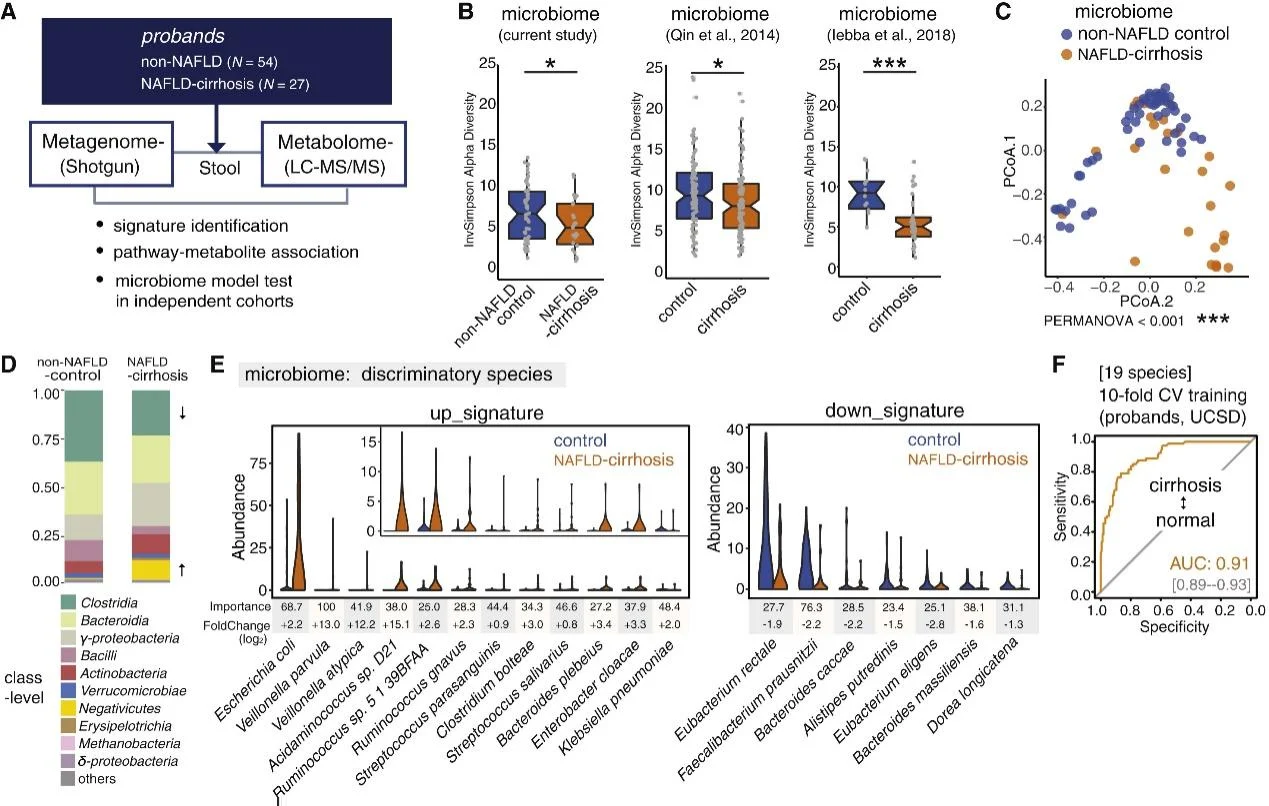
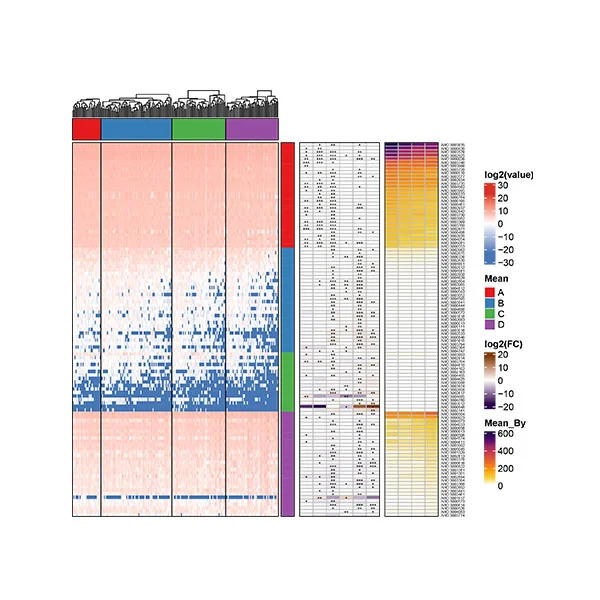
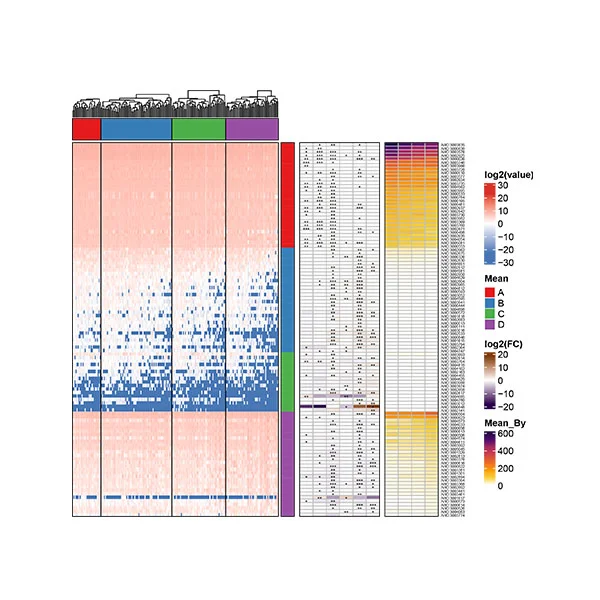
圖1 NAFLD肝硬化組與NAFLD對照組腸道菌群的主要變化
NAFLD-肝硬化患者的α-多樣性與對照組相比降低。主坐標分析發現肝硬化患者和對照組之間腸道菌群組成可以實現明顯分離,說明肝硬化患者腸道菌群組成出現明顯改變。NAFLD肝硬化的明顯成分變化包括Negativicutes的富集和梭狀芽孢桿菌類的減少。與NAFLD肝硬化相關的腸道微生物種類和臨床數據之間存在明顯的相關性。例如,Veillonella parvula的水平與白蛋白和血小板計數負相關,該參數在肝硬化患者中下降。與此相反,對照組中富集的Eubacterium eligens與白蛋白和血小板計數呈正相關。利用隨機森林和差異豐度分析識別出包含19個差異物種的腸道微生物組特征,準確地檢測出NAFLD肝硬化(AUC=0.91)。
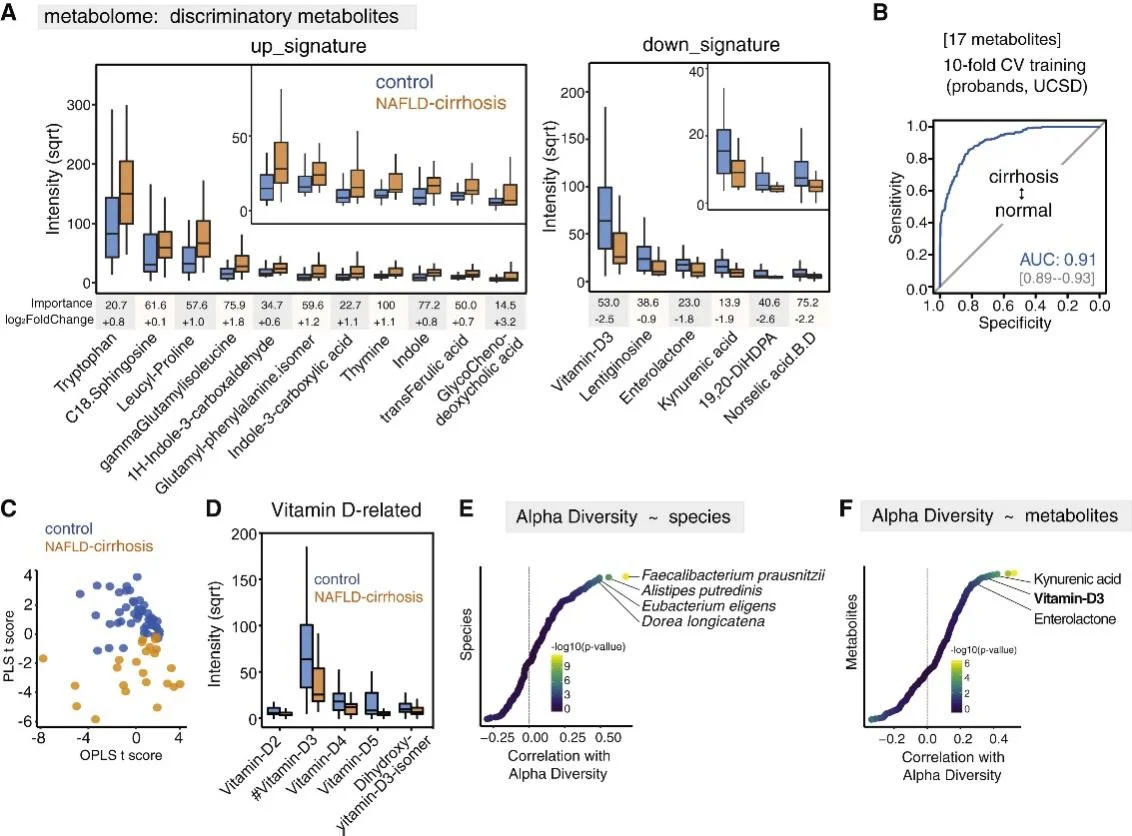
圖2 肝硬化差異代謝物的鑒定
進一步檢測NAFLD肝硬化患者和正常人群糞便代謝物的差異。通過相關性分析發現75種代謝物與肝硬化的臨床數據明顯相關。隨后利用隨機森林和差異豐度相結合的特征選擇篩選到17種代謝物,它們相結合能夠準確地區分正常和肝硬化狀態(AUC=0.91)。對肝硬化區分能力strongest代謝物包括AAA、BCAA、膽汁酸和維生素D的相關代謝產物。色氨酸及其相關代謝物如吲哚和犬尿酸也是代謝組特征中明顯變化的代謝物。
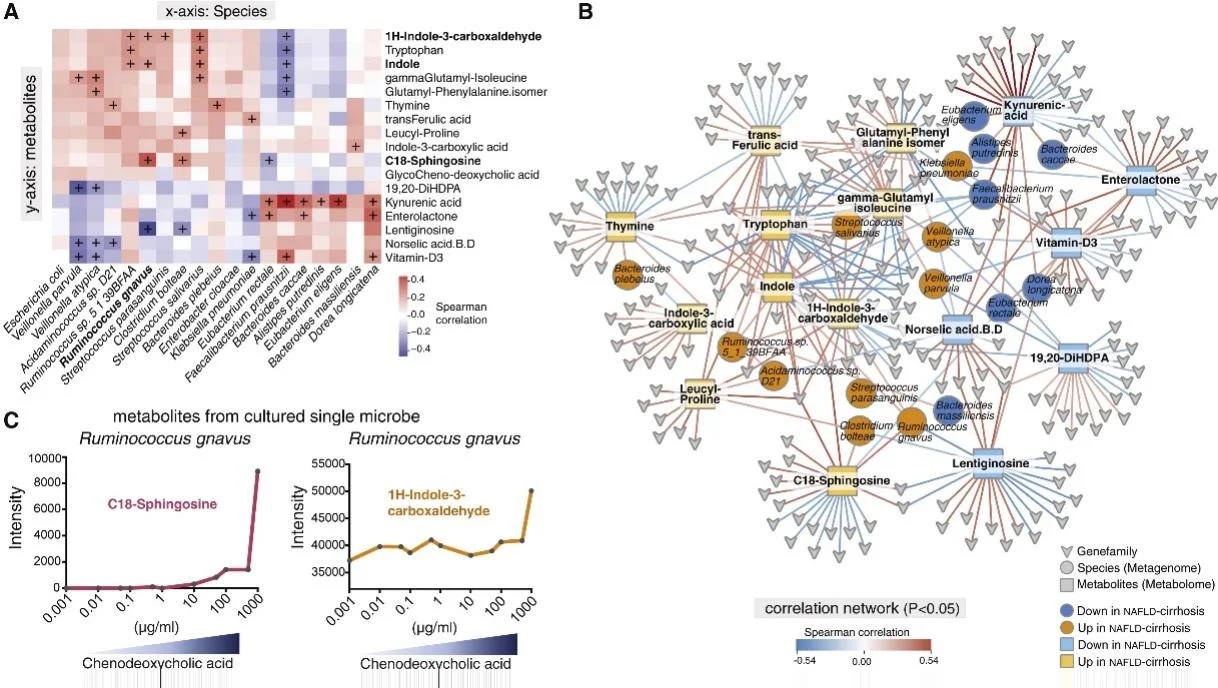
圖3 肝硬化的宏基因組和代謝組學特征的相互作用網絡
對關鍵的差異微生物和代謝物進行了的相關分析。C18-鞘氨醇水平與Ruminococcus gnavus豐度的增加相關。相反,犬尿酸水平與Faecalibacterium prausnitzii呈正相關。為了進一步驗證,在厭氧條件下,通過逐漸增加CDCA的濃度模擬肝硬化患者體內逐漸增加的膽汁酸水平,在此情況下培養Ruminococcus gnavus。結果發現C18 -鞘氨醇和1H-吲哚-3-羧醛的含量隨著CDCA濃度的增加而增加。該結果表明這些差異代謝物的產生是腸道微生物變化與肝臟互作的一種可能機制。
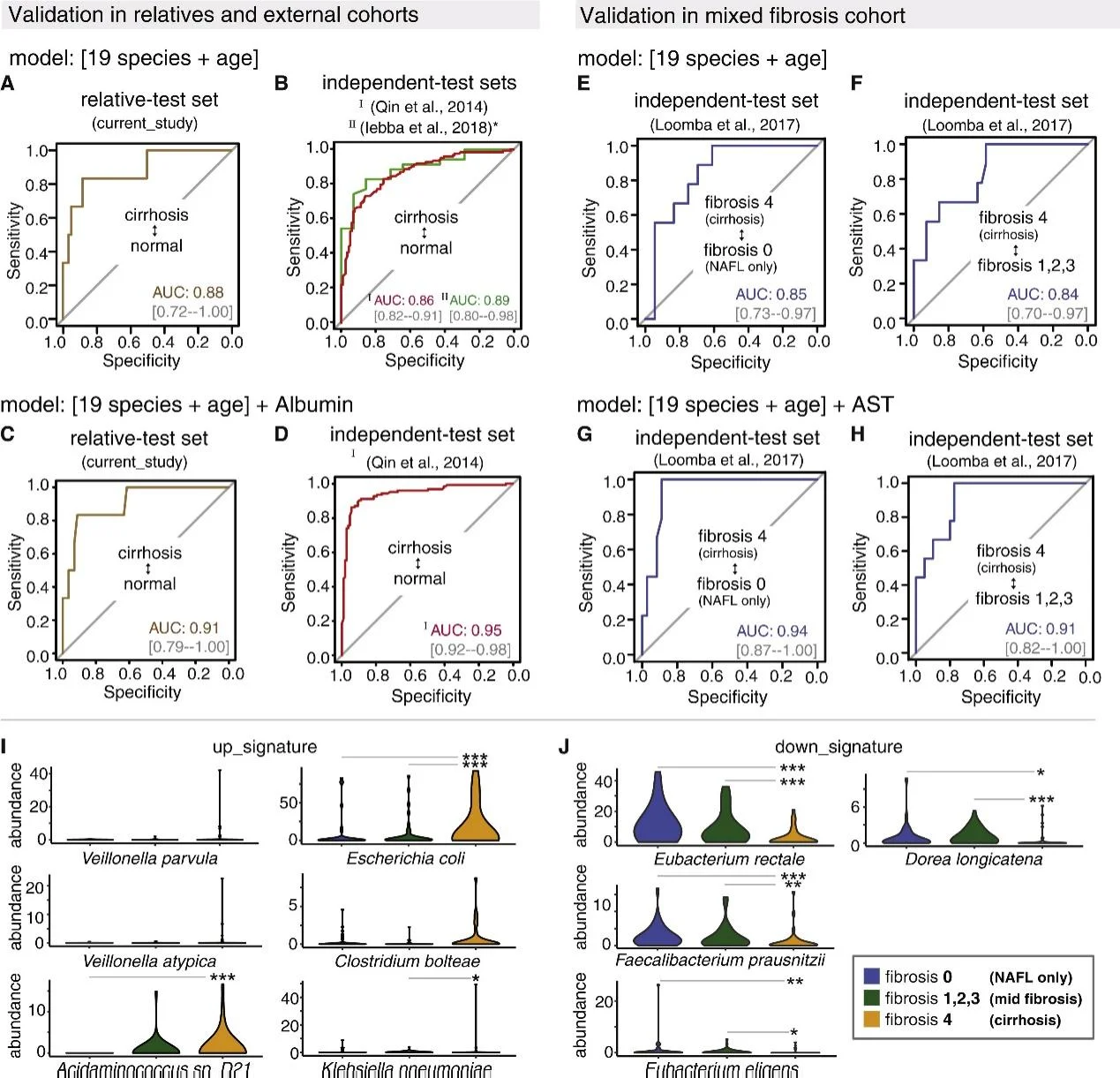
圖4 肝硬化糞便樣本宏基因組機器學習RF模型的驗證
基于19個菌種+年齡的診斷模型,在親屬隊列、中國和意大利不同肝硬化病因的隊列中也有很好表現,結合血清白蛋白可進一步提升準確性。在另一NAFLD隊列中,基于19個菌種+年齡+血清天冬氨酸氨基轉移酶水平的診斷模型能夠很好地區分肝硬化和早期肝纖維化。
4.研究結論
本研究證明了中心腸道微生物組特征可以在不同地域的隊列中識別肝硬化,并且單獨于疾病病因以及宿主遺傳學和環境因素對腸道微生物組的影響。研究中挖掘的微生物組衍生的診斷標志物的普遍適用性表明,其中的關鍵微生物物種可能在肝硬化的病理生理學中起到因果作用。本研究中發現的通用的微生物來源的特征為以糞便為基礎的診斷檢測進展纖維化或肝硬化高危個體奠定了基礎。
【實驗流程】
微生物組總DNA提取與質檢→DNA片段化→連接接頭序列→純化與分選→文庫擴增與純化→文庫質檢→高通量測序
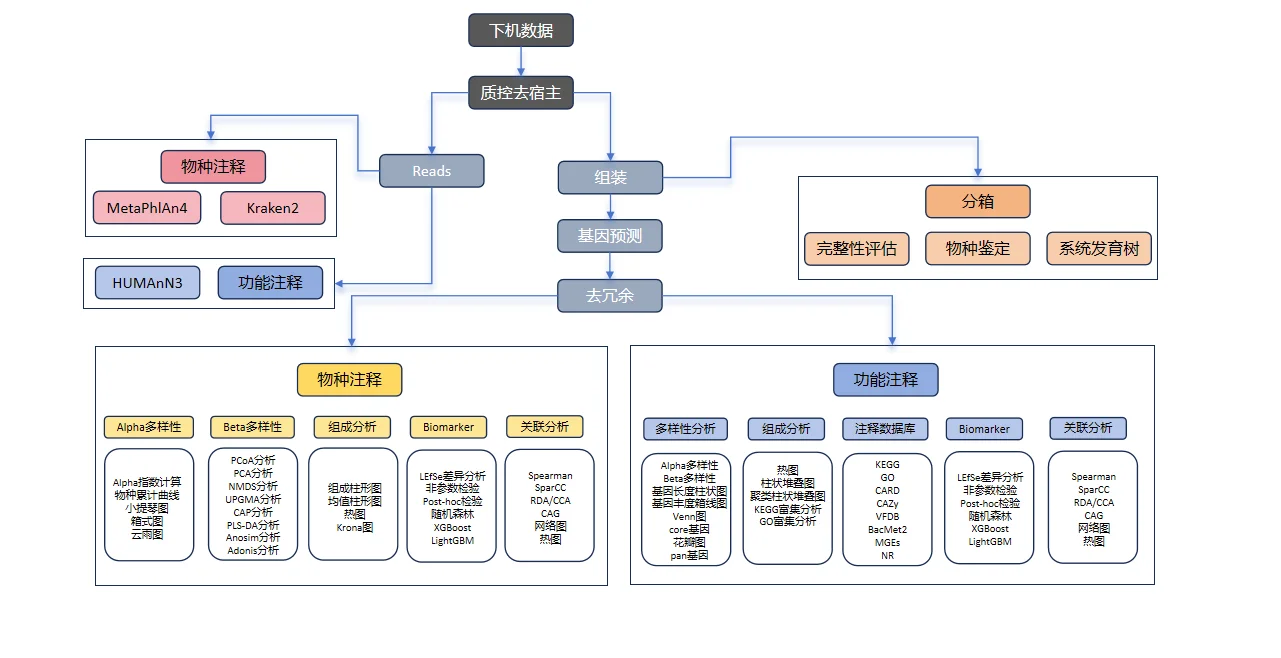
【分析流程】
【樣本要求】
在antibacterial藥物使用前采集標本;
注意采樣器具的無菌和嚴格無菌操作;
樣本信息的一致性和完整性。
|
樣本類型 |
樣本要求 |
儲存和運輸要求 |
|
糞便/腸道內容物 |
人糞便≥1g/例;大鼠糞便2-3顆;小鼠糞便≥4顆;人不成形稀便≥2mL/例。 采集容器潔凈無菌,不得混有尿液,不可有消毒劑、污水等其他污染物。 使用保護劑,需按照保護劑使用說明采集樣本量且充分混勻。 |
選擇合適的容器容納樣本,注意密封性,如有必要可用封口膜密封;容器上的樣本編號應清晰且不易脫落; 新鮮采集的樣本應立即-80℃/液氮保存,或暫至于干冰上轉移至-80℃/液氮保存;保存期間切忌反復凍融; 運輸時勿將最小單位的容器直接散落在干冰中;使用泡沫盒+干冰+冰袋的組合。 若無法滿足低溫儲藏及運輸的條件,可使用慕柏生物研發的保護劑(適用于糞便樣本)進行常溫儲存和運輸。 |
|
發酵液 |
≥1mL/例,離心沉淀菌體時應有明顯沉淀物。 |
|
|
唾液/痰液 |
≥1mL/例,建議晨起取樣且取樣前不要喝水/吸煙/飲酒/刷牙等。 |
|
|
土壤/沉積物 |
≥1g/例,需去除表層浮土、雜草、蟲子、細根等雜物。 |
|
|
DNA溶液 |
樣本總量:單次建庫的量為1μg,至少500ng; 樣本濃度≥10 ng/μL,以Qubit結果為準; DNA完整性:有明顯主帶,無降解; 若為特殊樣本抽提的DNA且不滿足樣本總量要求,需提前與技術支持溝通。 |
建議用封口膜密封離心管。 避免DNA反復凍融。-20℃/-40℃/-80℃皆可長期保存。 建議干冰運輸,若為閃送或當日達,可冰袋運輸。 |
|
其他 |
需提前與技術支持溝通 |
|
參考文獻
Oh, T. G. et al. A Universal Gut-Microbiome-Derived Signature Predicts Cirrhosis. Cell Metabolism, doi:10.1016/j.cmet.2020.06.005 (2020).
宏基因組測序
【技術原理】
宏基因組(Metagenomics),又稱元基因組,是以特定環境中的整個微生物群落作為研究對象,采用新一代高通量測序技術(NGS),對整個環境DNA進行大規模測序,隨后通過生物信息學方法進行基因搜索和功能注釋,獲得環境微生物基因信息總和,在研究環境微生物的群落結構、物種分類、系統進化關系的基礎上,可進一步探究微生物的基因功能活性、相互協作關系及微生物與環境之間的相互關系。
【技術優勢】
宏基因組測序擺脫了傳統研究中微生物分離培養的技術限制,直接提取環境樣本 DNA 進行測序,具有通量高、速度快、信息全等特點,在鑒定低豐度的微生物群落、挖掘更多基因資源方面具有很大優勢。
與微生物擴增子測序相比,宏基因組測序有其獨特的優勢。微生物擴增子測序靶向測序基因組上的一小段可反映物種進化地位的基因片段,可用于鑒定物種組成。宏基因組則是測序樣本的所有DNA,可以獲得樣本中物種組成和功能組成。所以,擴增子測序可以回答樣本中有哪些微生物,而宏基因組測序則不僅能回答樣本中有哪些微生物,還能回答它們有哪些功能潛力。
【研究方向】
基于測序技術和生物信息學的快速發展,宏基因組技術優勢在微生物研究領域中愈發明顯,應用范圍愈發普遍。在數據庫中積累大量新數據和發展更復雜的生物信息學方法,促使基于測序的宏基因組作為感興趣的功能活性篩選應用中可選擇的方法之一。基于測序的宏基因組,也提供了一種基于群落功能、群體功能差異化比較以及功能菌株搜尋探索的一種方法。
● 醫學領域:人體微生物與慢性疾病、tumor cancer、免疫系統、神經系統、母嬰/生殖、藥物療效關系的研究等
● 畜牧領域:腸道、瘤胃微生物與動物健康/營養消化關系的研究等
● 農業領域:土壤/根際微生物與植物互作、農業耕作/施肥處理關系的研究等
● 環境領域:微生物與環境污染物處理、石油降解及海洋環境的研究等
● 生物能源:特殊功能的菌株、基因挖掘、工程菌的開發研究
● 特殊極端環境:極端環境條件下的微生物類群研究
【案例介紹】

標題:一組通用的腸道微生物來源的標志物可預測肝硬化
期刊:Cell Metabolism
影響因子:29
研究對象:NAFLD肝硬化
1.研究背景
非酒精性脂肪性肝病(NAFLD)是世界范圍內慢性肝病的主要病因,NAFLD肝硬化是該病的the latest of Late形式,也是肝細胞cancerHCC)的主要危險因素。目前迫切需要準確的、非侵入性的檢測來確定晚期NAFLD風險大的患者。
腸道菌群紊亂與非酒精性脂肪肝進一步發展為晚期纖維化和肝硬化的過程密切相關,在一些研究中發現腸道菌群的特征可準確檢測肝硬化患者。然而,考慮到宿主和環境因素對腸道菌群的影響,基于微生物的診斷特征的普遍適用性尚不清楚。
2.研究方法
這項研究納入了163個來自正常對照和NAFLD肝硬化患者及其家庭成員的糞便樣本進行宏基因組測序和非靶向代謝組學檢測,探究NAFLD肝硬化相關的微生物和代謝特征。隨后,通過隨機森林機器學習和差異豐度分析,分別構建基于宏基因組和代謝組數據的NAFLD肝硬化診斷模型,篩選出能指示NAFLD肝硬化的菌群和代謝標志物。Final,研究者分別在51名非NAFLD、21名無進展纖維化的NAFLD患者、3名NAFLD相關纖維化患者和7名NAFLD-肝硬化患者的一級隊列,同時結合已發表的不同地域和宿主遺傳背景的相關研究中的隊列數據中再次驗證了該模型的診斷準確性。
3.研究結果

圖1 NAFLD肝硬化組與NAFLD對照組腸道菌群的主要變化
NAFLD-肝硬化患者的α-多樣性與對照組相比降低。主坐標分析發現肝硬化患者和對照組之間腸道菌群組成可以實現明顯分離,說明肝硬化患者腸道菌群組成出現明顯改變。NAFLD肝硬化的明顯成分變化包括Negativicutes的富集和梭狀芽孢桿菌類的減少。與NAFLD肝硬化相關的腸道微生物種類和臨床數據之間存在明顯的相關性。例如,Veillonella parvula的水平與白蛋白和血小板計數負相關,該參數在肝硬化患者中下降。與此相反,對照組中富集的Eubacterium eligens與白蛋白和血小板計數呈正相關。利用隨機森林和差異豐度分析識別出包含19個差異物種的腸道微生物組特征,準確地檢測出NAFLD肝硬化(AUC=0.91)。

圖2 肝硬化差異代謝物的鑒定
進一步檢測NAFLD肝硬化患者和正常人群糞便代謝物的差異。通過相關性分析發現75種代謝物與肝硬化的臨床數據明顯相關。隨后利用隨機森林和差異豐度相結合的特征選擇篩選到17種代謝物,它們相結合能夠準確地區分正常和肝硬化狀態(AUC=0.91)。對肝硬化區分能力strongest代謝物包括AAA、BCAA、膽汁酸和維生素D的相關代謝產物。色氨酸及其相關代謝物如吲哚和犬尿酸也是代謝組特征中明顯變化的代謝物。

圖3 肝硬化的宏基因組和代謝組學特征的相互作用網絡
對關鍵的差異微生物和代謝物進行了的相關分析。C18-鞘氨醇水平與Ruminococcus gnavus豐度的增加相關。相反,犬尿酸水平與Faecalibacterium prausnitzii呈正相關。為了進一步驗證,在厭氧條件下,通過逐漸增加CDCA的濃度模擬肝硬化患者體內逐漸增加的膽汁酸水平,在此情況下培養Ruminococcus gnavus。結果發現C18 -鞘氨醇和1H-吲哚-3-羧醛的含量隨著CDCA濃度的增加而增加。該結果表明這些差異代謝物的產生是腸道微生物變化與肝臟互作的一種可能機制。

圖4 肝硬化糞便樣本宏基因組機器學習RF模型的驗證
基于19個菌種+年齡的診斷模型,在親屬隊列、中國和意大利不同肝硬化病因的隊列中也有很好表現,結合血清白蛋白可進一步提升準確性。在另一NAFLD隊列中,基于19個菌種+年齡+血清天冬氨酸氨基轉移酶水平的診斷模型能夠很好地區分肝硬化和早期肝纖維化。
4.研究結論
本研究證明了中心腸道微生物組特征可以在不同地域的隊列中識別肝硬化,并且單獨于疾病病因以及宿主遺傳學和環境因素對腸道微生物組的影響。研究中挖掘的微生物組衍生的診斷標志物的普遍適用性表明,其中的關鍵微生物物種可能在肝硬化的病理生理學中起到因果作用。本研究中發現的通用的微生物來源的特征為以糞便為基礎的診斷檢測進展纖維化或肝硬化高危個體奠定了基礎。
【實驗流程】
微生物組總DNA提取與質檢→DNA片段化→連接接頭序列→純化與分選→文庫擴增與純化→文庫質檢→高通量測序
【分析流程】

【樣本要求】
在antibacterial藥物使用前采集標本;
注意采樣器具的無菌和嚴格無菌操作;
樣本信息的一致性和完整性。
|
樣本類型 |
樣本要求 |
儲存和運輸要求 |
|
糞便/腸道內容物 |
人糞便≥1g/例;大鼠糞便2-3顆;小鼠糞便≥4顆;人不成形稀便≥2mL/例。 采集容器潔凈無菌,不得混有尿液,不可有消毒劑、污水等其他污染物。 使用保護劑,需按照保護劑使用說明采集樣本量且充分混勻。 |
選擇合適的容器容納樣本,注意密封性,如有必要可用封口膜密封;容器上的樣本編號應清晰且不易脫落; 新鮮采集的樣本應立即-80℃/液氮保存,或暫至于干冰上轉移至-80℃/液氮保存;保存期間切忌反復凍融; 運輸時勿將最小單位的容器直接散落在干冰中;使用泡沫盒+干冰+冰袋的組合。 若無法滿足低溫儲藏及運輸的條件,可使用慕柏生物研發的保護劑(適用于糞便樣本)進行常溫儲存和運輸。 |
|
發酵液 |
≥1mL/例,離心沉淀菌體時應有明顯沉淀物。 |
|
|
唾液/痰液 |
≥1mL/例,建議晨起取樣且取樣前不要喝水/吸煙/飲酒/刷牙等。 |
|
|
土壤/沉積物 |
≥1g/例,需去除表層浮土、雜草、蟲子、細根等雜物。 |
|
|
DNA溶液 |
樣本總量:單次建庫的量為1μg,至少500ng; 樣本濃度≥10 ng/μL,以Qubit結果為準; DNA完整性:有明顯主帶,無降解; 若為特殊樣本抽提的DNA且不滿足樣本總量要求,需提前與技術支持溝通。 |
建議用封口膜密封離心管。 避免DNA反復凍融。-20℃/-40℃/-80℃皆可長期保存。 建議干冰運輸,若為閃送或當日達,可冰袋運輸。 |
|
其他 |
需提前與技術支持溝通 |
|
參考文獻
Oh, T. G. et al. A Universal Gut-Microbiome-Derived Signature Predicts Cirrhosis. Cell Metabolism, doi:10.1016/j.cmet.2020.06.005 (2020).



 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~